
2025-04-11 14:19:16
歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負責協調。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負責提供科學意見。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),由歐盟委員會做出是否授權的終決定。這個決定在整個歐盟都是具有法律約束力的。 審批過程: 申請人向EMA提交申請,包括eCTD(電子通用技術文檔)格式的藥品注冊文檔。 EMA的CHMP分配一個科學評估團隊(Rapporteur和Co-Rapporteur),負責初步評估。 CHMP基于評估團隊的報告提供科學意見。 歐盟委員會根據CHMP的意見做出終決定,批準或拒絕藥品上市。 授權范圍 如果藥品獲得批準,將獲得在整個歐盟、冰島、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA)。澳大利亞ANDA注冊申報相關技術支持。安徽中國eCTD遞交

電子簽章與傳輸** 文件需經AES-256加密后刻錄至不可擦寫光盤,并附MD5校驗碼。光盤損壞或病毒污染將觸發重遞交流程,原載體按銷毀程序處理。 ?審評與核查協同 自2018年起,FDA要求提交兩套光盤分別用于審評和現場核查,2022年調整為“1套審評+1套核查+1套專項資料”模式,提升流程效率。 ?國際化兼容性增強 美國eCTD系統支持與歐盟、日本等地區的XML互操作性,但區域差異(如模塊1的標簽要求)仍需人工適配。 ?未來通道創 FDA計劃引入API接口支持企業系統直連,并探索基于云存儲的實時提交與審評,減少物理媒介依賴。安徽中國eCTD遞交美國eCTD注冊外包相關技術支持。
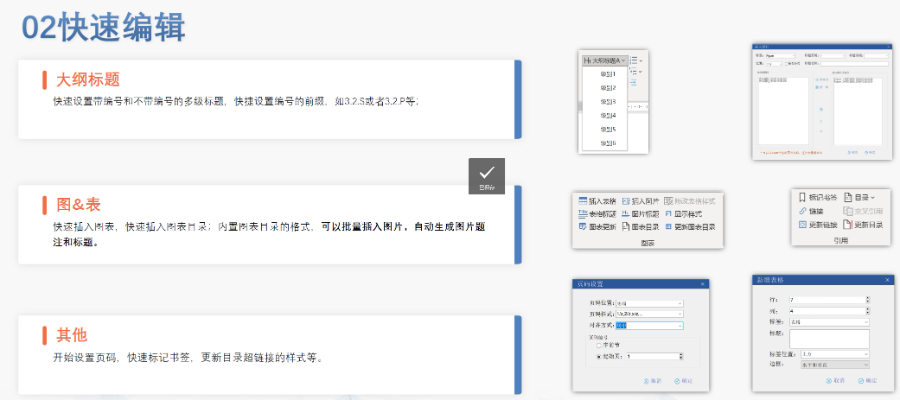
賦悅Word插件 自主研發Word插件 快速編輯:整合word常用功能按鈕,避免頻繁切換菜單;內置標題、段落、文字、目錄、超鏈接等的格式和樣式,可快速設置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,制作文本超鏈接或者題注超鏈接;可搜索全文關鍵字,自動制作超鏈接 文檔拆分:可根據不同的條件將word文件顆粒化,如分節符、頁眉、頁腳、頁碼范圍和自定義頁碼等 PDF轉換:WORD轉PDF,自動判斷是否生成書簽,自動鑲嵌所有字體,生成PDF快速網頁瀏覽的PDF,確保生成的PDF所有屬性符合法規要求 文檔驗證:驗證文檔的字體、字號、紙張、頁面布局、空白頁、頁碼、編號、目錄、超鏈接等,并且可以定位驗證結果 可定制:可根據用戶需求定制格式和樣式模板
區域化差異與多國協作挑戰 歐盟eCTD需兼容成員國特定要求,例如模塊一的**信息需符合各國語言和法規差異。互認程序(MRP)中,參考成員國(RMS)的評估報告需被其他成員國認可,若出現分歧需由CMDh協調或提交EMA仲裁。這種多層級審評機制要求申請人在文件準備階段即考慮區域兼容性,避免后續流程延誤。 eCTD4.0的探索與未來方向 ICH于2015年發布的eCTD4.0版本旨在簡化目錄結構、支持多產品類型(如**器械)申報,并增強生命周期管理功能。歐盟計劃通過2024年試點逐步過渡至4.0,其扁平化文件組織方式有望減少重復提交并提升審評效率。然而,實施需解決現有系統兼容性及行業適應性問題。加拿大eCTD驗證標準相關技術支持。

ANDA一般不需要提供臨床前(動物)和臨床(人體)數據來證明其**性和有效性(即免毒理和臨床),作為替代,申請人必須合理證明其產品與原研藥相比是生物等效的。 按照《聯邦食品、藥品和化妝品法》第 505(j)章要求,擬向FDA遞交申請ANDA的藥品需符合以下條件: 仿制藥必須依照FDA《經過**等同性評價批準的藥品》(俗稱"橙皮書")上所列,由FDA選定的RLD/RS進行對照仿制; 活性成份、劑型、規格、給藥途徑、適應癥,要與RLD相同; 仿制藥必須證明與RLD在生物效果上等同,即具有生物等效性; 必須按照美國聯邦管理法21 CFR遵行藥品生產管理規范控制生產過程; 無論中國還是美國,要求仿制藥的質量必須等同或者是高于參比制劑的,這是獲批的基本要點; 注意:如果原研藥未被列為RLD,申請人可以提出公民,向FDA申請。歐盟ANDA注冊申報相關技術支持。安徽中國eCTD遞交
歐盟IND注冊申報相關技術支持。安徽中國eCTD遞交
美國于2003年成為全球早采用eCTD(電子通用技術文檔)的**之一,初由CDER和CBER作為電子提交平臺試點。2008年起,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標準格式,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位。至2017年,FDA強制要求所有藥申請(NDA)、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,標志著其從可選到強制的轉型。這一進程在2018年擴展至臨床試驗申請(IND),終實現全類型藥品注冊的電子化覆蓋安徽中國eCTD遞交